
|
 |
[PRDX1 family]
PRDX1; PEROXIREDOXIN 1
[別名]
PRX1,
PAGA; PROLIFERATION-ASSOCIATED GENE A
NKEFA; NATURAL KILLER-ENHANCING
FACTOR A
PRDX2; PEROXIREDOXIN 2
[別名]
PRX2
TDPX1, TPX1; PEROXIDE REDUCTASE, THIOREDOXIN-DEPENDENT
NKEFB; NATURAL
KILLER-ENHANCING FACTOR B
PRDX3; PEROXIREDOXIN 3
[別名]
PRX3,
AOP1; ANTIOXIDANT PROTEIN 1
PRDX4; PEROXIREDOXIN 4
[別名]
AOE372;
ANTIOXIDANT ENZYME 372
PRDX5; PEROXIREDOXIN 5
[別名]
AOEB166
PRDX6; PEROXIREDOXIN 6
[別名]
PHOSPHOLIPASE A2, LYSOSOMAL
キーワード
抗酸化酵素、チオレドキシン、過酸化水素、レドックス制御、分子シャペロン
歴史とあらまし
従来、過酸化水素や過酸化物を消去する酵素としてはカタラーゼやグルタチオンペルオキシダーゼが知られていたが、近年、チオレドキシン依存性の過酸化水素消去酵素が同定され、チオレドキシンペルオキシダーゼと呼ばれた。その後、様々な生物種でこのファミリーに属すると考えられるタンパク質が次々に発見され、ペルオキシレドキシンファミリーという総称が与えられた。
分子構造
現在ペルオキシレドキシンファミリーには、1から6の6個のアイソフォームがある。これらはその分子構造の違いから3つのグループに分けられる(Ref 1)。1)
2-Cys Prx;N末とC末の両方によく保存されたシステイン残基をもち、その両方が活性に必要である。2) atypical 2-Cys
Prx;N末にのみ保存されたシステイン残基をもつが、活性の発現にはもう一つ別のシステイン残基を必要とする。3) 1-Cys
Prx;N末にのみシステイン残基をもち、活性発現にはこのシステイン残基のみが必要である。哺乳類のPrx 1から4は、2-Cys
Prxに属し、それらのアミノ酸配列はN末とC末のシステイン残基の周りを中心に相同性が高い。Prx 5はatypical 2-Cys Prx に属する。Prx
1から4のアミノ酸配列とは相同性は低いが、N末のシステイン残基(Cys 47)の周りは相同性が高い。Prx 6は1-Cys Prx に属する。
Prx
1及び2は細胞質3はミトコンドリア、4は小胞体とリソソーム及び細胞外(分泌型)、5はペルオキシゾームとミトコンドリア、6は細胞質とミトコンドリアに存在する。
機能
1. 細胞内過酸化水素濃度の制御
ペルオキシレドキシンは過酸化水素を水に還元する過酸化水素消去酵素である。過酸化水素を還元することにより自身の持つシステイン残基は酸化されて活性を失うが、チオレドキシンによって再還元される触媒サイクルを形成している(図)。過酸化水素は、細胞内で様々なタンパク質のシステイン残基を酸化することによりそのタンパクの機能を制御し(レドックス制御)、細胞内メッセンジャーとして働いている。しかし一方で、ヒドロキシルラジカルなど毒性の強い活性酸素を生成し、細胞に酸化障害を与えるという二面性を持っている。このため、細胞内の過酸化水素濃度を制御することは細胞の機能を維持するために非常に重要である。ペルオキシレドキシンは、細胞質に非常に豊富にあり(Prxs
I 及び II)、過酸化水素に対する親和性が高く(Km<20 µM Prxs I 及び II)、細胞内の過酸化水素濃度を制御する重要な酵素の一つである。
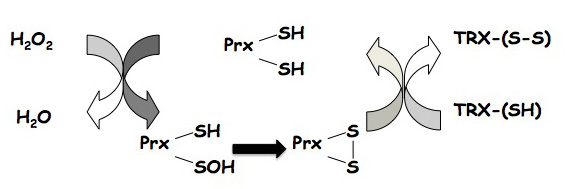
図 Prx: ペルオキシレドキシン, TRX; チオレドキシン
SH, SOHなどはシステイン残基の酸化還元状態を示す
2. 分子シャペロン
最近、2-Cys Prxに分子シャペロンとしての新たな機能が発見された(Ref
2-4)。酸化ストレスや熱ストレスにより、通常の低分子量タイプのペルオキシレドキシンが構造変化を起こし、高分子量複合体を形成する。この高分子量複合体は分子シャペロンとしての機能を持ち、ストレスによって障害を受けたタンパクの除去修復に関与する。
老化・老年病における意義
Prx 2のノックアウトマウスの細胞は、β-ガラクトシダーゼ陽性細胞の割合が野生型マウスの細胞に比べ30%くらい高く、細胞老化が早い。また皮膚組織でも、表皮や真皮のコラーゲンが低下するなど、ノックアウトマウスで老化が亢進しており、Prx 2は細胞老化や皮膚の老化を防御する役割を果たしていることが示唆されている(Ref 5)。
Database
PRDX1, PRDX2, PRDX3, PRDX4, PRDX5, PRDX6
参考文献
1) Rhee, S. G., H. Z. Chae, et al. Peroxiredoxins: a historical overview and
speculative preview of novel mechanisms and emerging concepts in cell
signaling. Free Radic Biol Med 38:1543-52, 2005 (PMID: 15917183)
2)Jang,
H. H., K. O. Lee, et al. Two enzymes in one; two yeast peroxiredoxins
display oxidative stress-dependent switching from a peroxidase to a
molecular chaperone function. Cell 117: 625-35. 2004 (PMID: 15163410)
3)Moon, J. C., Y. S. Hah, et al. Oxidative stress-dependent structural and
functional switching of a human 2-Cys peroxiredoxin isotype II that enhances
HeLa cell resistance to H2O2-induced cell death. J Biol Chem 280: 28775-84,
2005 (PMID: 15941719)
4) Jang, H. H., S. Y. Kim, et al. (2006). "Phosphorylation
and concomitant structural changes in human 2-Cys peroxiredoxin isotype I
differentially regulate its peroxidase and molecular chaperone functions."
FEBS Lett 580: 351-5. (PMID: 16376335)
5)Han, Y. H., H. S. Kim, et al.
Inhibitory role of peroxiredoxin II (Prx II) on cellular senescence. FEBS
Lett 579: 4897-902, 2005 (PMID: 16109412)
作成者
三浦ゆり、遠藤玉夫 20111130
Update 20120517