
|
 |
SMP30; SENESCENCE MARKER PROTEIN 30
[別名]
RGN;
REGUCALCIN
キーワード
サリン、ルシフェリン、ビタミンC、gluconolactonase、COPD
歴史とあらまし
1992年、ラット肝臓の可溶化成分の加齢変化についてプロテオーム解析を行い、加齢に伴い減少する蛋白として報告された(Ref.1, 2)。他の研究者によりカルシウム結合蛋白質として報告されたが結合性の確認はされていない。遺伝子は7つのエクソンからなりX染色体上に位置している(Ref. 3)。
分子構造
299個のアミノ酸からなる分子量約3万のモノマーと考えられている。アミノ酸配列は種間で強く維持されハエ・蚊を始めとして酵母等にも存在している。例外的に線虫には相同性を示す遺伝子は発見されていない。
機能
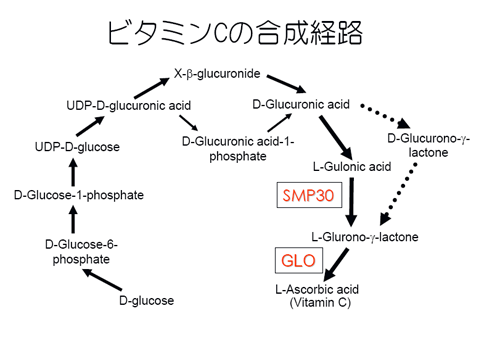
発見当初は構造中に機能ドメインが認められなく機能は不明であった。米国研究者によりサリンを分解するorganophosphatase活性が報告された(Ref 4)。ホタルの発光器中に酸化ルシフェリンをルシフェリンに再生する酵素(LRE)がホタルSMP30であることが報告された(Ref 5)。培養細胞を用いた解析では形質膜カルシウムポンプ活性を亢進することが明らかとなった(Ref 6)。その後、藍藻類のgluconolactonaseがクローニングされたがラットSMP30と高い相同性が認められた。基質特異性も完全に一致していたことから高等動物のgluconolactonaseと確認された。Gluconolactonaseはマウス・ラット体内におけるアスコルビン酸(ビタミンC)合成に必須の酵素である (下図、Ref 7)。
老化・老年病における意義
SMP30は実験動物およびヒトにおいては加齢に伴い発現が減少する。ノックアウトマウスは野生型に比較して早期に死亡する(Ref 8)。死因は出血、腫瘍、炎症等は認められないが高度の羸痩があり代謝異常が背景にあると思われる。早期にリポフスチンと老化関連βガラクトシダーゼが認められ早期に老化が出現するモデルマウスとして有用と考えられる(Ref 9)。野生型と比較してノックアウトマウスの臓器は易傷害性であり高齢者の臓器障害に対応する。SMP30欠損マウスを用いた喫煙実験では早期に肺胞が破壊されCOPD(慢性閉塞性呼吸器疾患)に罹患しやすいという結果が得られた(Ref 10)。
Database
参考文献
1)
Fujita T, Uchida K, Maruyama N. Purification of senescence marker
protein-30 (SMP30) and its androgen-independent decrease with age in the rat
liver. Biochim Biophys Acta 1116:122-128, 1992
2)
Fujita T, Shirasawa T, Uchida K, Maruyama N. Isolation of cDNA clone encoding
rat senescence marker protein-30 (SMP30) and its tissue distribution. Biochim
Biophys Acta 1116:297-305, 1992
3)
Fujita T, Mandel JL, Shirasawa T, Hino O, Shirai T, Maruyama N. Isolation
of cDNA clone encoding human homologue of senescence marker protein-30 (SMP30)
and its location on the X chromosome. Biochim Biophys Acta. 1263:249-52., 1995
4)
Billecke SS, Primo-Parmo SL, Dunlop CS, Doorn JA, La Du BN, Broomfield CA.
Characterization of a soluble mouse liver enzyme capable of hydrolyzing
diisopropyl phosphorofluoridate. Chem Biol Interact. 119-120:251-6, 1992
5) Gomi K, Hirokawa K, Kajiyama N. Molecular cloning and expression of the cDNAs
encoding luciferin-regenerating enzyme from Luciola cruciata and Luciola
lateralis. Gene. 294:157-66, 2002
6)
Fujita T, Inoue H, Kitamura T, Sato N, Shimosawa T, Maruyama N. Senescence
marker protein-30 (SMP30) rescues cell death by enhancing plasma membrane
Ca2+-pumping activity in Hep G2 cells. Biochem Biophys Res Commun 250:374-380,
1998
7)
Kondo Y, Inai Y, Sato Y, Handa S, Kubo S, Shimokado K, Goto S, Nishikimi M,
Maruyama N, Ishigami A. SMP30 functions as gluconolactonase in L-Ascorbic acid
biosynthesis and its knockout mice are prone to scurvy. Proc Natl Acad Sci, USA
103:5723-5728, 2006
8)
Ishigami A, Fujita T, Handa S, Shirasawa T, Koseki H, Kitamura T, Enomoto N,
Sato N, Shimosawa T, Maruyama, N. Senescence marker protein-30 knockout mouse
liver is highly susceptible to TNF-α- and Fas-mediated apoptosis. Amr J Pathol
161:1273-1281, 2002
9)
Yumura W, Imasawa T, Ishigami A, Suganuma S, Handa S, Kubo S, Maruyama N.
Accelerated tubular cell senescence in SMP30 knockout mice. Histol Histopathol
21:1151-1156, 2006
10)
Sato T, Seyama K, Sato S, Mori H, Souma S, Akiyoshi T, Kodama Y, Mori T,
Goto S, Takahashi K,
Fukuchi Y, Maruyama N, Ishigami A. Senescence Marker Protein-30 protects mice
lungs from oxidative stress, aging and smoking. Am J Respir Crit Care Med
174:530-537, 2006
作成者
丸山直記、石神昭人、近藤嘉高 080402
Update Oct. 07, 2008